Mit der Zulassung von Lecanemab zur Behandlung der frühen Alzheimer-Demenz steht erstmals ein Medikament zur Verfügung, welches das Fortschreiten der Erkrankung verlangsamen kann. Allerdings kommt Lecanemab aufgrund des Wirkprinzips und potenzieller Risiken nur für einen Teil der betroffenen Patientinnen und Patienten infrage. Zudem steht die Nutzenbewertung für den deutschen Versorgungskontext noch aus. Infrage steht, wie viele Patientinnen und Patienten potenziell mit Lecanemab therapiert werden könnten. Eine aktuelle Auswertung des Zentralinstituts für die kassenärztliche Versorgung (Zi) liefert hierzu Zahlen und macht darauf aufmerksam, welche Leistungen des ambulanten Versorgungsbereichs dafür notwendig werden.
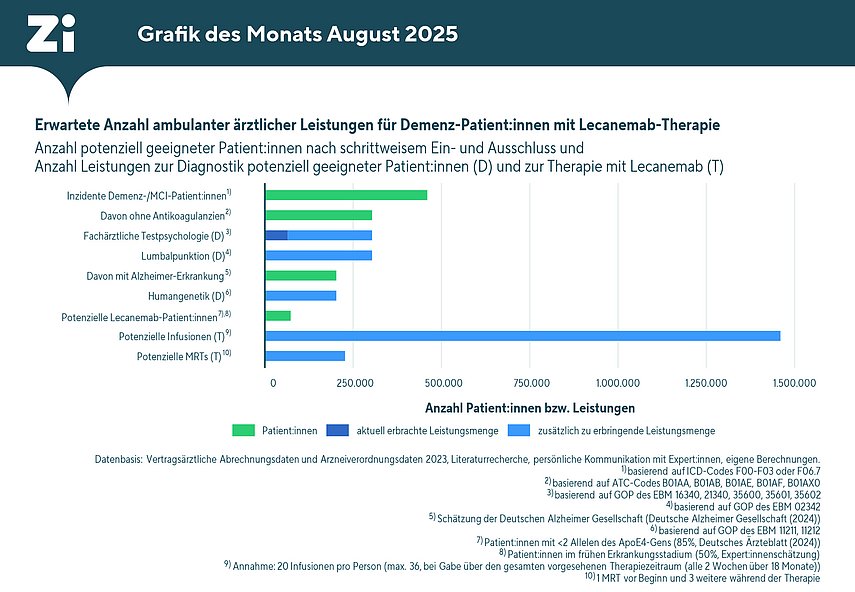
Auf Grundlage der Zahl neu diagnostizierter Patientinnen und Patienten mit Demenz oder leichter kognitiver Beeinträchtigung (mild cognitive impairment – MCI) im Jahr 2023 (n = 460.000) wurde ein mögliches Mengengerüst für die zukünftige Versorgung im Zusammenhang mit einer Therapie mit Lecanemab erstellt. Die Berechnungen basieren auf den derzeit definierten Voraussetzungen für den Einsatz des Wirkstoffs und dienen der Abschätzung der zu erwartenden Patientenzahl sowie der damit verbundenen medizinischen Leistungen. Das Mengengerüst unterscheidet dabei zwischen den erforderlichen diagnostischen Maßnahmen (D) zur Identifikation geeigneter Patientinnen und Patienten und den Leistungen im Rahmen der eigentlichen Therapie (T) mit Lecanemab.
Im ersten Schritt der Modellierung wurden Personen ausgeschlossen, die Blutverdünner (Antikoagulanzien) einnehmen, da für diese Gruppe eine Behandlung mit Lecanemab kontraindiziert ist. Nach diesem Ausschluss verbleiben rund 303.600 potenziell geeignete Patientinnen und Patienten. Für diese Gruppe sind zunächst standardisierte diagnostische Verfahren bei Demenzverdacht sowie der Nachweis einer Alzheimer-Erkrankung mittels Lumbalpunktion notwendig. Verglichen mit den bisherigen Fallzahlen in der Diagnostik führt diese Entwicklung zu einer voraussichtlich deutlichen Ausweitung der erbrachten kassenärztlichen Leistungen, insbesondere in den Fachrichtungen Neurologie und Psychiatrie.
Nach Schätzung der Deutschen Alzheimer Gesellschaft entfallen etwa zwei Drittel aller Demenzerkrankungen in Deutschland auf die Alzheimer-Demenz, was rund 202.400 Personen entspricht. Für diese Patientengruppe ist zusätzlich ein Bluttest zur Bestimmung des ApoE4-Gens erforderlich. Das Vorliegen der homozygoten ApoE4-Genvariante stellt eine Kontraindikation für die Behandlung mit dem Wirkstoff Lecanemab dar. Unter der Annahme, dass ca. 85 Prozent der Patientinnen und Patienten nur eine oder keine Kopie dieser Genvariante aufweisen und sich ca. 50 Prozent in dem für die Behandlung erforderlichen frühen Demenzstadium befinden, verbleiben 73.000 potentielle Patientinnen und Patienten, für die eine Therapie mit Lecanemab in Frage kommt. Diese Zahl ist als optimistische Schätzung zu verstehen: Sie basiert auf festen Ausschlusskriterien und bildet somit das theoretische obere Limit der Behandlungsberechtigten – etwa im Hinblick auf weiterführende Maßnahmen wie Infusionen und MRT-Kontrollen. Die regelmäßige Verabreichung von Lecanemab (alle 14 Tage per Infusion über einen Zeitraum von bis zu 18 Monaten) sowie die nötigen MRT-Kontrollen zur Überwachung möglicher Nebenwirkungen führen ebenfalls zu einem erheblichen Anstieg der benötigten Leistungen.
Das sind die zentralen Ergebnisse einer Datenanalyse zur erwarteten Anzahl ambulanter vertragsärztlicher Leistungen, die in Verbindung mit der Diagnostik und der Therapie von Demenzpatientinnen und -patienten mit dem neuen Wirkstoff Lecanemab stehen.
„Mit der erfolgten Zulassung und nach Abschluss der Nutzenbewertung steht mit Lecanemab erstmals ein Medikament zur Verfügung, das eine beginnende Demenz in ihrem Fortschreiten verlangsamen und so den Patientinnen und Patienten sowie ihren Angehörigen mehr Zeit in besserer Gesundheit verschaffen kann. Lecanemab ist jedoch nicht für jede an Demenz erkrankte Person geeignet. Aufgabe der behandelnden Fachärztinnen und Fachärzte wird es daher sein, mit bestimmten diagnostischen Verfahren die Patientinnen und Patienten zu finden, die am meisten von der Therapie profitieren und für die die Anwendung am sichersten ist. Hausärztinnen und Hausärzten sowie den neuropsychiatrischen Fachärztinnen und Fachärzten kommt hier eine besondere Rolle zu. Dies wird bei der Einführung zu bedenken sein. Bisher stand die Auswirkung einer Arzneimittelinnovation auf den zusätzlichen Bedarf an ärztlicher Diagnostik und Beratung nicht im Fokus der Betrachtung. Tatsächlich entsteht aber erheblicher zusätzlicher Zeitbedarf in den Praxen. Im Praxisalltag müssen konkurrierende Ansprüche an die verfügbaren Kapazitäten abgewogen werden. Vor allem aber müssen regulierende Einschränkungen auf die Leistungsmenge beseitigt und eine auskömmliche Vergütung der Praxen gewährleistet sein, damit dem Interesse der Patientinnen und Patienten, die viel Hoffnung in die Behandlung mit Lecanemab legen, im Versorgungsalltag auch entsprochen werden kann“, sagte der Zi-Vorstandsvorsitzende Dr. Dominik von Stillfried.
Lecanemab ist ein monoklonaler Antikörper, der seit April 2025 in der Europäischen Union zur Behandlung der frühen Alzheimer-Demenz bzw. einer leichten kognitiven Störung (MCI) zugelassen ist. Trotz Zulassung ist das Medikament in Deutschland noch nicht verfügbar. Der Hersteller muss zunächst ausführliche Aufklärungsmaterialien bereitstellen. Erst danach kann Lecanemab in Deutschland ärztlich verordnet und die frühe Nutzenbewertung initiiert werden. Weitere Informationen zu Lecanemab finden Sie auf der Website des IQWIG.
Bildunterschrift:
Erwartete Anzahl ambulanter ärztlicher Leistungen für Demenz-Patient:innen mit Lecanemab-Therapie
Datenbasis:
Vertragsärztliche Abrechnungsdaten und Arzneiverordnungsdaten 2023
Die Meldungund die Grafikzum Download.
Zi-Kodier-Manual “Demenz und andere Kognitive Defizite”